<div>
<div>
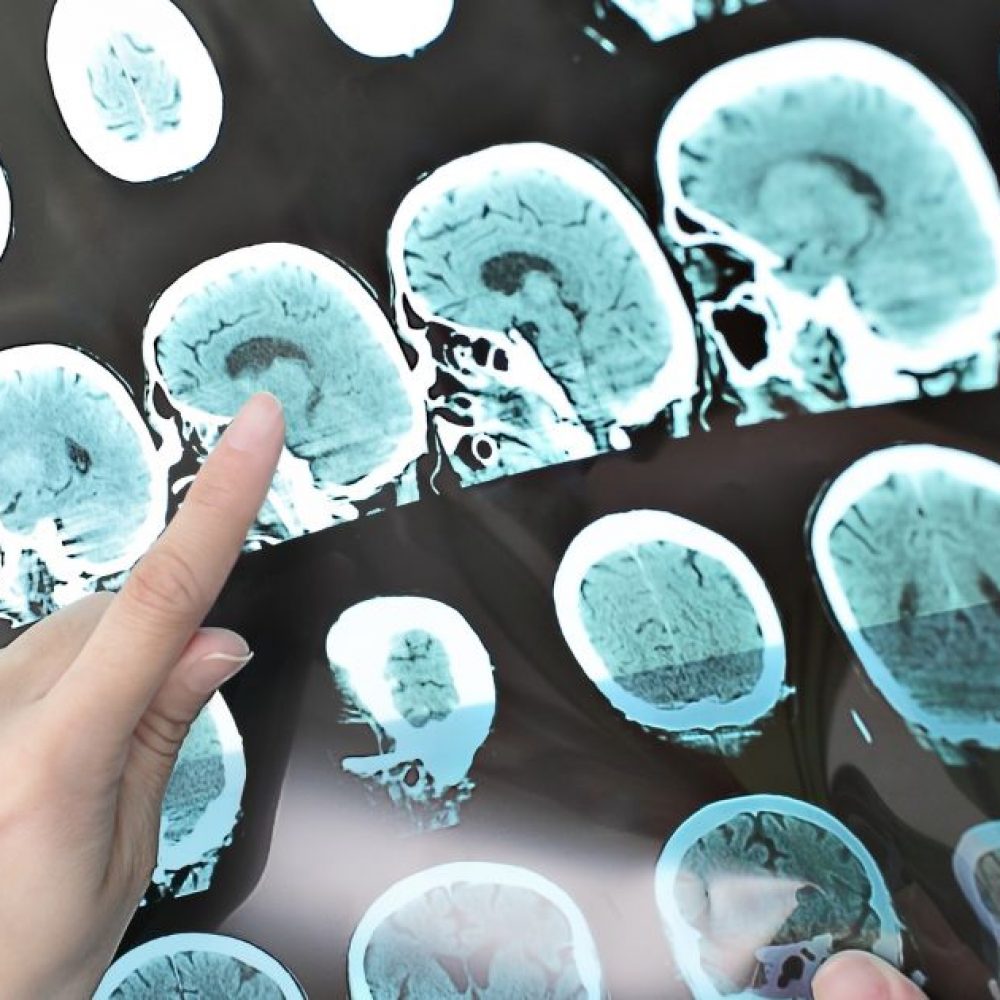
<p><span style="font-size: small;">Η Genzyme, μια εταιρεία του ομίλου Sanofi, ανακοίνωσε τα νέα δεδομένα μαγνητικής απεικόνισης (MRI) από το κλινικό πρόγραμμα ανάπτυξης του (alemtuzumab). Στους ασθενείς που αντιμετωπίστηκαν με alemtuzumab στις δύο κλινικές μελέτες Φάσης III (τόσο ασθενείς που δεν είχαν λάβει θεραπεία προηγουμένως, όσο και ασθενείς με ενεργή νόσο υπό άλλη αγωγή), τα αποτελέσματα μαγνητικής απεικόνισης (MRI) που παρατηρήθηκαν μετά από δύο έτη διατηρήθηκαν και κατά το τρίτο έτος (πρώτο έτος της μελέτης επέκτασης). Τα παραπάνω δεδομένα, παρουσιάστηκαν στο 66ο Ετήσιο Συνέδριο της Αμερικανικής Ακαδημίας Νευρολογίας (American Academy of Neurology [AAN :</span></p>
</div>
</div>
<p><span style="font-size: small;"><br />•Σταθερά αποτελέσματα παρατηρήθηκαν στο σύνολο των βασικών μετρήσεων της δραστηριότητας της νόσου (βλάβη προσλαμβάνουσα γαδολίνιο (gd) υπέρπυκνη T2 και υπόπυκνη T1 βλάβη) και τα αποτελέσματα που παρατηρήθηκαν μετά τα δύο έτη θεραπείας διατηρήθηκαν κατά το τρίτο έτος.<br />•Κατά το τρίτο έτος της παρακολούθησης, πάνω από το 70% των ασθενών δεν παρουσίασε στη MRI δραστηριότητα ενδεικτική οξείας φλεγμονής, η οποία ορίζεται ως βλάβη προσλαμβάνουσα γαδολίνιο (gd) ή νέες ή αυξημένες σε μέγεθος υπέρπυκνες T2 βλάβες.<br />•Ο όγκος των Τ2 βλαβών, που αντιπροσωπεύει τη συνδυαστική επιβάρυνση της μόνιμης εγκεφαλικής βλάβης και του σχηματισμού νέων βλαβών,αυξήθηκε μεταξύ του δευτέρου και τρίτου έτους, αλλά παρέμεινε κάτω από την αρχική τιμή πριν την έναρξη τη θεραπείας.<br />•Το ποσοστό ατροφίας, όπως μετρήθηκε με βάση το κλάσμα του εγκεφαλικού παρεγχύματος, το οποίο είχε ήδη μειωθεί μετά τα δύο έτη, συνέχισε να εμφανίζει επιβραδυντικούς ρυθμούς και στη διάρκεια του τρίτου έτους παρακολούθησης.<br />•Περίπου 80% των ασθενών υπό θεραπεία με alemtuzumab δεν έλαβαν τρίτη συνεδρία θεραπείαςκατά το πρώτο έτος της μελέτης επέκτασης .<br /><br /><em>"Το αξιοσημείωτο με αυτά τα δεδομένα είναι ότι τα θετικά αποτελέσματα βάσει μαγνητικής απεικόνισης (MRI) του alemtuzumab διατηρήθηκαν κατά τη μελέτη επέκτασης, παρόλο που οι περισσότεροι ασθενείς δεν έλαβαν πρόσθετη θεραπεία με alemtuzumab</em><em>. Αυτή η παρατήρηση είναι μοναδική στο σύγχρονο θεραπευτικό πλαίσιο της ΠΣ</em><em>,"</em> δήλωσε ο Douglas Arnold, M.D., NeuroRx Research and Department of Neurology and Neurosurgery Νευρολογικό Ινστιτούτο Μόντρεαλ, ΠανεπιστήμιοMcGill. <em>"Τα νέα απεικονιστικά αποτελέσματα (MRI) αποτελούν μια σημαντική προσθήκη στα κλινικά δεδομένα από τη μελέτη επέκτασης που κατέδειξε</em><em>την επίδραση του alemtuzumab σε βασικές μετρήσεις της κλινικής δραστηριότητας της νόσου, συμπεριλαμβανομένου του ποσοστού υποτροπών ανά έτος και της επιδείνωσης της αναπηρίας</em><em>."<br /></em>Οι πιο συχνές ανεπιθύμητες ενέργειες του alemtuzumab είναι αντιδράσεις σχετιζόμενες με την έγχυση (πονοκέφαλος, εξάνθημα, πυρετός, ναυτία, κόπωση, κνίδωση, αϋπνία, κνησμός, διάρροια, ρίγη, ζάλη, και ερυθρίαση), λοιμώξεις (του ανώτερου αναπνευστικού και του ουροποιητικούσυστήματος), και λεμφοπενία. Αυτοάνοσες διαταραχές (όπως ανοσολογική θρομβοκυτταροπενία, λοιπές κυτταροπενίες, σπειραματονεφρίτιδα και θυρεοειδική νόσος) και σοβαρές λοιμώξεις ενδέχεται να παρουσιαστούν σε ασθενείς που λαμβάνουνalemtuzumab. Ένα ολοκληρωμένο πρόγραμμα διαχείρισης κινδύνου που περιλαμβάνει εκπαίδευση και παρακολούθησηθα υποστηρίξει την έγκαιρη ανίχνευση και διαχείριση των εν λόγω εντοπισμένων κινδύνων. Τα αποτελέσματα ασφάλειας από το πρώτο έτος της μελέτης επέκτασης έχουν ήδη ανακοινωθείγια ασθενείς που έλαβαν alemtuzumabστις μελέτες Φάσης III CARE-MS. Δεν εντοπίστηκαν νέοι κίνδυνοι. Όπως αναφέρθηκε στο παρελθόν, σημειώθηκαν δύο θάνατοι κατά τη μελέτη επέκτασης. Ο ένας προήλθε από σήψη και ο άλλος θεωρήθηκε ατύχημα και μη σχετιζόμενος με τη θεραπεία της μελέτης.<br /><br />Οι κλινικές μελέτες Φάσης III του alemtuzumab ήταν τυχαιοποιημένες μελέτες διετούς διάρκειας που σύγκριναν τη θεραπεία με alemtuzumab με την υψηλή δόση της υποδόριας ιντερφερόνης βήτα-1α σε ασθενείς με υποτροπιάζουσα διαλείπουσα ΠΣ (RRMS) που είχαν ενεργή νόσο και είτε δεν είχαν λάβει θεραπεία προηγουμένως (CARE-MS I), είτε είχαν υποτροπιάσει κατά τη διάρκεια προηγούμενης θεραπείας (CARE-MS ΙΙ). Σε αυτές τις μελέτες, οι ασθενείς στην ομάδα τουalemtuzumabέλαβαν δύο συνεδρίες θεραπείας, η πρώτη χορηγήθηκε ενδοφλεβίως σε πέντε διαδοχικές ημέρες και η δεύτερη χορηγήθηκε σε τρεις διαδοχικές ημέρες,12 μήνες αργότερα.<br /><br />Οι ασθενείς που έλαβαν θεραπεία με alemtuzumab οι οποίοι συνέχισαν χωρίς διακοπή την παρακολούθηση και στη μελέτη επέκτασης, ήταν υποψήφιοι να λάβουν εκ νέου θεραπεία, εφόσον υπήρχαν τεκμηριωμένα στοιχεία δραστηριότητας της νόσου. Αυτή η ανάλυση περιλάμβανε 349 ασθενείς που έλαβαν θεραπεία με alemtuzumab από τη μελέτηCARE-MS I και 393που έλαβαν θεραπεία με alemtuzumabαπό τη μελέτη CARE-MS II· 18% και 20%, αντίστοιχα, έλαβαν πρόσθετη θεραπεία. Οι απεικονίσεις μέσω μαγνητικού συντονισμού (MRI scans) λήφθηκαν κατά την έναρξη των μελετών CARE-MS, και στους 12, 24, και 36μήνες.<br /><br />"<em>Δεδομένης της σημασίας που έχει η μαγνητική απεικόνιση(MRI) στη μέτρηση της δραστηριότητας της νόσου στην ΠΣ, τα αποτελέσματα για το alemtuzumab που ανακοινώθηκαν είναι σημαντικά,</em>" δήλωσε ο Πρόεδρος και CEO της Genzyme, David Meeker, M.D. "<em>Αυτά τα αποτελέσματα ενδυναμώνουν τη δυνατότητα που διαθέτει το</em><em>alemtuzumab να αλλάξει τη θεραπεία της ΠΣ</em>."<br /><br />Στη μελέτη CARE-MS I, το alemtuzumab υπήρξε πιο αποτελεσματικό από την ιντερφερόνη βήτα-1α στη μείωση του ποσοστού υποτροπών ανά έτος·η διαφορά που παρατηρήθηκε στην επιβράδυνση της εξέλιξης της αναπηρίας δεν ήταν στατιστικά σημαντική. Στη μελέτη CARE-MS II, το alemtuzumab ήταν σημαντικά πιο αποτελεσματικό σε σχέση με την ιντερφερόνη βήτα-1α στη μείωση του ποσοστού υποτροπών ανά έτος, και η εξέλιξη της αναπηρίας επιβραδύνθηκε σημαντικά σε ασθενείς που έλαβαν alemtuzumab έναντι ιντερφερόνης βήτα-1α.<br /><br /><strong>Σχετικά με το (alemtuzumab)</strong></span></p>
<p><span style="font-size: small;"><strong></strong><br />Το alemtuzumab έχει λάβει έγκριση στην Ευρωπαϊκή Ένωση, την Αυστραλία, τη Βραζιλία, τον Καναδά και το Μεξικό. To alemtuzumab δεν έχει προς το παρόν λάβει έγκριση στις Ηνωμένες Πολιτείες. Μετά από εποικοδομητικές συζητήσεις με τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ, η Genzyme σχεδιάζει να υποβάλει εκ νέου κατά το δεύτερο τρίμηνο του 2014 αίτηση για έγκριση τουalemtuzumab στις ΗΠΑ. Η εκ νέου υποβολή θα παρέχει πληροφορίες που αντιμετωπίζουν επακριβώς τα θέματα που είχαν προηγουμένως τεθεί από τον Οργανισμό Τροφίμων και Φαρμάκων (FDA) των ΗΠΑ στην Πλήρη Απαντητική Επιστολή του τον Δεκέμβριο του 2013. Αιτήσεις κυκλοφορίας για τοalemtuzumabβρίσκονται επίσης υπό αξιολόγηση σε άλλες χώρες. Το alemtuzumab υποστηρίζεται από ένα ολοκληρωμένο και εκτενές πρόγραμμα κλινικής ανάπτυξης πουπεριλάμβανε σχεδόν 1.500 ασθενείς και 5.400 ανθρωποέτη παρακολούθησης.<br /><br />Το alemtuzumab είναι ένα μονοκλωνικό αντίσωμα που στοχεύει επιλεκτικά το CD52, μια πρωτεΐνη που βρίσκεται σε αφθονία στην επιφάνεια των Τ και Β κυττάρων. Η θεραπεία με alemtuzumab έχει ως αποτέλεσμα την εξάλειψη των Τ και Β κυττάρων της κυκλοφορίας, τα οποία θεωρούνται υπεύθυνα για τη ζημιογόνα φλεγμονώδη διαδικασία στην ΠΣ. Η δράση του alemtuzumab σε άλλα κύτταρα του ανοσολογικού συστήματος θεωρείται αμελητέα.Η άμεση αντιφλεγμονώδης δράση του alemtuzumab ακολουθείται από ένα διακριτό πρότυπο επαναποικισμού των Τ και Β κυττάρων που συνεχίζεται σε βάθος χρόνου και αποκαθιστά νέα ισορροπία στο ανοσοποιητικό σύστημα με τέτοιο τρόπο που δυνητικά περιορίζει τη δράση της ΠΣ.<br /> <br />Η Genzyme διατηρεί τα παγκόσμια δικαιώματα για το alemtuzumab και φέρει την κύρια ευθύνη για την ανάπτυξη και την εμπορική προώθησή τους στην Πολλαπλή Σκλήρυνση. Η Bayer HealthCare διατηρεί δικαίωμα επιλογής για συν-προώθηση του alemtuzumab στην Πολλαπλή Σκλήρυνση στις ΗΠΑ.Μετά την εμπορική διάθεση του προϊόντος, η Bayer θα λάβει έκτακτες πληρωμές βάσει των εσόδων από τις παγκόσμιες πωλήσεις.<br /></span><span><br /></span></p>